Лейкоз – генерализованная форма рака
Курсовая работа
на тему:
«Лейкоз – генерализованная форма рака»
2009
Рак — проблема XX века
Строго научное определение «рак» объединяет лишь злокачественные опухолевые заболевания кожи и производных его зачаткового листка. Более широкое понятие рака, распространенное, в частности, у неспециалистов и среди населения и используемое нами здесь, объединяет все злокачественные опухолевые заболевания, число которых превышает сто наименований. Среди них и быстро завершающиеся смертельным исходом саркомы не костной ткани, и вяло текущие хронические заболевания лимфатической системы, сопровождаемые нередко длительными ремиссиями (т. е. временными улучшениями здоровья). Канцерогенез (от латинского слова «канцер» — рак) описывает многоэтапный процесс перехода здоровой ткани злокачественную, важнейший этап которого — малигнизация связан с трансформацией, т. е. с непосредственным приобретением клетками свойств злокачественности.
Главные среди этих свойств следующие: способность к безудержному размножению клеток, переставших подчиняться регулирующим механизмам организма-хозяина; способность проникать, прорастать в окружающие здоровые ткани и вызывать в них нарушения в функционировании п повреждения; способность отрываться от основной опухоли и переноситься с током крови и лимфы в другие органы и ткани и образовывать в них вторичные опухоли — метастазы; способность вызывать общие нарушения обмена веществ и отравлять организм продуктами распада опухолевых клеток.
Коварство рака связано с тем, что организм не чувствует появления начальных этапов канцерогенеза, и обычно впервые обращаются к врачу, когда началась уже прогрессия сформировавшейся опухоли (ее быстрый рост), препятствующий нормальному функционированию ряда органов. Из этого следует чрезвычайная важность исследований механизмов самых ранних этапов канцерогенеза в доклинический период.
Коварство рака связано и с бесконечным разнообразием факторов, способствующих и вызывающих рак. Поиск общих для них закономерностей также относится к первоочередным задачам исследователей.
Рак стал болезнью XX в по числу смертельных исходов рак занимает второе место после сердечнососудистых заболеваний. Однако страх у населения перед угрозой заболеть раком выше, чем каким-либо другим заболеванием. Это связано как с действительным повышением частоты злокачественных заболеваний за последние 50—100 лет, так и с определенной информированию населения о возможности современными лечебными средствами противостоять неотвратимому смертельному исходу, особенно в случае раннего обращения больного к врачу.
Повышение частоты злокачественных заболеваний связано с улучшением выявления рака, с увеличением средней продолжительности жизни людей и с увеличением контингента людей, имеющих контакт с различными потенциально канцерогенными факторами на работе и в окружающей среде.
Рак не есть болезнь только XX в. и только человека. Различными формами злокачественных опухолевых заболеваний практически болеют все виды многоклеточных организмов животного и растительного мира. Рак старше человека. Рак (остеосаркомы и другие формы) обнаружен и среди ископаемых остатков растений и животных, живших задолго до появления человека на Земле, например у динозавров. Следовательно, эволюционно-биологический подход к проблеме рака может оказаться очень полезным в изучении его загадок, в изучении этиологии (причин) и механизмов его развития.
О причинах возникновения рака и возможностях его лечения среди неспециалистов бытует много легенд, далеких от реальной действительности. На самом деле имеется большое количество разнообразных опухолевых злокачественных заболеваний, которым, тем не менее, присущи некоторые общие черты. В случае несвоевременной диагностики и лечения действительно неотвратимо наступает смертельный исход. Однако нельзя к диагнозу рака относиться как к смертельному приговору. К настоящему времени накоплено много материалов, свидетельствующих о важности участия самого больного в определении исхода заболевания, о еще большей важности состояния организма в предшествующий период, когда человек еще здоровым не подозревал, что многое из его образа жизни, его привычек и поведения может привести к возникновению изменений в организме, способствующих развитию рака. Эти изменения накапливались в так называемый передпатологический период.
Большинство форм рака носит локальный характер, но оказывает пагубное влияние на весь организм. Наиболее генерализованной формой опухолевых заболеваний является лейкоз — рак крови, что связало с интегрирующей ролью системы крови. Лейкозным клеткам присущи те же основные отличия от нормальных клеток, что и клеткам других злокачественных опухолей, и те же причины их возникновения. По лейкозу имеются надежные статистические данные, особенно по лейкозам радиационной этиологии, и более изучены взаимоотношения опухоли и организма. Наконец, именно на примере лейкоза наиболее подробно исследован период предпатологических изменений, определяющих в реальных условиях вероятность злокачественного заболевания человека.
Поэтому в дальнейшем мы будем в основном излагать материал, относящийся к лейкозам, обобщая основные клинические сведения о лейкозах человека и подчеркивая определяющую роль нарушений взаимосвязи различных систем организма в предпатологический период, имеющих не специфический по отношению к лейкозу характер, механизм их возникновения и пути предотвращения или устранения их.
По вопросам этиологии и возможным механизмам развития рака имеется большое число работ. В них обсуждается вопрос, почему может произойти малигнизация клеток у отдельных лиц, но нет ответа на другой — почему у абсолютного большинства людей, подвергающихся такому же воздействию канцерогенных факторов и условий, злокачественные заболевания не возникают. Кроме того, они не дают возможности понять всю последовательность событий, происходящих на уровнях молекулярно-клеточном и тканевом, на уровне физиологических систем организма, формирующих пред раковые и пред лейкозные состояния с последующим возможным переходом в рак и лейкоз.
Характерной особенностью последних лет стали серьезное обсуждение и поиск доказательств обратимости злокачественного процесса. Поднимается вопрос: является ли соматическая мутация, т. е. возникшее наследственное изменение, основным механизмом злокачественной трансформации? На факты, не совместимые с мутационной гипотезой, обращал внимание В. С. Шапот [1975]. Он писал: «Отсутствие в раковой клетке какого-либо специфического белка делает неправдоподобным предположение об участии матировавших структурных генов в неопластическом превращении. Вся сложность проблемы состоит в том, что раковая клетка создается из нормальных элементов» (с. 237). Об этом писали и другие авторы.
Аналогичное положение и с хромосомными изменениями. В большинстве случаев не выявляется однозначной закономерной связи между хромосомной характеристикой опухоли или клеточной линии, и ее морфологическими и физиологическими свойствами (Е. А. Погосьянц, А. Д. Захаров). Так называемая филадельфийская хромосома встречается не у всех больных лейкозом (даже при хроническом лимфолейкозе), но в то же время она может быть и в клетках, не подвергающихся малигнизации.
В последние годы удалось доказать возможность получения нормальных поколений клеток из некоторых опухолевых тканей. На основе факта наличия опухолевых клеток иммунных, обменных и ультраструктурных признаков, характерных для эмбриональных клеток, М.Г. Эренпрейс делает категорическое заключение о том, что ничего другого, кроме эмбрионизации, при канцерогенезе не происходит и какими-либо особыми свойствами, кроме эмбриональных, опухолевые клетки не обладают. Эта крайняя точка зрения также отвергает основополагающую роль в первичных механизмах малигнизации мутаций, генных и хромосомных нарушений.
Как же быть тогда с гипотезой о вирусной природе происхождения злокачественных опухолей и лейкоза? Последние обзоры по этой проблеме (например, Н.П. Мазуренко) подтвердили реальность вирусной этиологии ряда злокачественных заболеваний у животных, но не у человека (кроме редко встречаемой в отдельных районах Африки лимфомы Беркита). Для человека рак — незаразная болезнь. Для него признаются ведущими факторами, по мнению Н.П. Мазуренко, процессы, происходящие в самом организме, и прежде всего связанные с его старением или с дисбалансом его систем в более молодом возрасте. У животных опухолевые процессы вирусного происхождения в эксперименте развиваются только при определенном гормональном статусе организма, при определенном повреждении и раздражении тканевой системы, в которую инокулируется вирус, или при искусственном изолировании группы клеток от влияния нормальной тканевой и организменной регуляции.
Не следует также забывать, что злокачественная трансформация определенного числа клеток еще не означает неизбежного развития злокачественного заболевания. При сохранении системы иммунологического надзора организм способен обезвреживать и уничтожать большое число клеток, приобретших черты иммунологической чужеродности.
Эпидемиология лейкоза и других необластозов
Эпидемиология изучает географию заболевания и вероятность его связи с окружающей средой, традициями быта, питания и поведения. По официальным статистическим данным разных стран, на злокачественные опухолевые заболевания кроветворной системы (они объединяются общим термином «гемобластозы») приходится около 50% всех случаев смерти в возрасте до 30 лет. Это связано с тем, что в отличие от ряда других опухолей многие формы гемобластозов встречаются и в детском и в юношеском возрасте. У человека гемобластозы встречаются у 10—12% онкологических больных. С учетом потери трудоспособности гемобластозы занимают обычно третье место среди новообразований после рака желудка и легких. В течение многих десятилетий наблюдалось увеличение заболеваний гемобластозами в СССР и в Европе.
Однако в последнее десятилетие замедлился рост частоты заболеваний лейкозом. Для населения США это стало заметно примерно с 1965 г. Тем не менее в 1977 г. из пяти наиболее распространенных злокачественных заболеваний среди мужской части населения США в возрастных группах до 15 лет и 15—34 года больше всего погибло от лейкоза. В 1979 г. число больных гемобластозами в США составляло около 88 300, а в мире — около 1 млн. 766 тыс. человек.
В СССР общее число больных злокачественными, заболеваниями лимфатической и кроветворной ткани составило в 1979 г. 23 139 человек, или 8,8 случая на 100 000 жителей [Напалков и др., 1981]. Доля этих заболеваний среди всех онкологических болезней была практически одинаковой для городского (4,4%) и сельского (4,3%) населения при очень больших различиях в отдельных республиках (2,6 и 13,6 случая на 100 000 населения соответственно для Таджикистана и Литвы). По прогнозам до 1990 г. заболеваемость раком крови еще будет расти. Для человека наиболее надежные статистические сведения получены о неопластических процессах радиационной этиологии (медицинское применение ионизирующей радиации и радиационные последствия взрывов атомных бомб в Хиросиме и Нагасаки).
Джон Бойс обработал и обобщил в Национальном институте рака США накопленные в разных странах к 1980 г. сведения о частоте возникновения различных неопластических заболеваний за длительные отрезки времени (десятилетия) после медицинского применения радиации (радиотерапия анкилозоспондилита, острого мастита, гипертрофии тимуса у детей, тонзиллита, туберкулезного аденита, гемангиомы; радиационная кастрация женщин; облучение волосяного покрова головы детей; флюороскопия груди; радиационная пельвиметрия беременных женщин; общая рентгенодиагностика; радиотерапия шейки матки; введение в организм радиоактивных веществ: радия — 224 для лечения костного туберкулеза и анкилозоспондилита, фосфора — 32 при полицетимии, йода — 131 при тиреотоксикозе, тория — 232 в качестве контрастного средства при рентгенодиагностике). Обрабатывались единым методом данные, имеющие достаточное дозиметрическое описание. Сведения относятся более чем 150 тыс. человек, получавших радиационные воздействия. На основе обобщения автором сделаны следующие основные заключения:
1) однократное воздействие радиации в определенной дозе вызывает увеличение частоты злокачественных заболеваний спустя много лет;
2) радиационный рак не отличается от спонтанно возникающего и вызванного другими причинами;
3) молочная железа, щитовидная железа и кроветворение являются наиболее чувствительными к индукции злокачественных опухолей радиационной этиологии;
4) злокачественные заболевания крови (лейкозы) являются наиболее вероятными среди других типов злокачественных заболеваний, индуцируемых радиацией;
5) увеличение частоты лейкозов начинается спустя 2—4 года после воздействия радиации. Максимум заболеваний отмечен спустя 6—8 лет после воздействия радиации, затем до 25-летнего периода уменьшалась частота индуцированных лейкозов;
6) солидные опухоли имели минимальный латентный период, равный примерно 10 годам, а некоторые из них появлялись лишь по достижении облученным организмом того возраста, когда обычно появляются спонтанные опухоли;
7) возраст человека в момент облучения является самым важным фактором организма, влияющим на последующую вероятность индукции злокачественного заболевания;
8) процент увеличения злокачественных заболеваний в расчете на дозу 0,01 Гр неодинаковый для всех типов заболеваний. Некоторые виды заболеваний, спонтанно возникающие с высокой частотой (рак толстой кишки), обладали относительно низкой индукцией при воздействии радиации, в то время как другие, возникающие спонтанно сравнительно редко, показали высокую индукцию их радиацией (рак щитовидной железы);
9) кривые доза—эффект имели часто линейный характер, но также наблюдали и кривые с оптимумом дозы для индукции злокачественных заболеваний, т. е. с неэффективным облучением при высоких дозах, что могло быть связано как с гибелью наиболее радиочувствительных клеток, так и (или) с влиянием факторов, определяющих выраженность заболевания.
Последние обобщения Национальным институтом рака США материалов последствии ядерных взрывов в Хиросиме и Нагасаки выявили также много нового. В дополнение к ранее сообщавшимся видам злокачественных заболеваний, таким, как лейкоз, рак щитовидной железы, молочной железы и легких, теперь надо добавить еще рак пищевода, желудка, мочевых органов и лнмфомы как последствия воздействия ионизирующей радиации в событиях 1945 г. Обоснованность доказательств радиационной природы этих заболеваний возросла.
Лейкоз был самой частой радиационной причиной гибели человека по сравнению с другими видами злокачественных заболеваний, имевших место у жителей Хиросимы и Нагасаки, подвергшихся воздействию повреждающих факторов атомного взрыва. За 24-летннй период от лейкоза погибло людей больше, чем от других злокачественных заболеваний, вместе взятых. Максимум лейкозов наблюдался в период 1950—1954 гг., т. е. через 5—10 лет после радиационного воздействия. В течение 1970—1974 гг., т. е. спустя 25—30 лет после взрывов атомных бомб, еще отмечались случаи радиационного лейкоза. Однако вероятность их возникновения стала существенно ниже, чем, например, вероятность возникновения рака органов пищеварения у пострадавших жителей Хиросимы и Нагасаки.
Среднее превышение частоты лейкозов в Хиросиме над этим же показателем в Нагасаки (примерно в 2— 3 раза выше) связывают с более выраженным лейкозогенным эффектом нейтронов, которых в ионизирующей радиации было больше в Хиросиме — до 30% в радиационной дозе. При теоретическом анализе кривых доза — эффект допускается вид кривой с оптимумом дозы, превышение которой уменьшает канцерогенный эффект. На риск канцерогенного действия радиации влияет целый ряд факторов во время облучения и в последующий период, в частности возраст и состояние организма. Считается также, что состояние медицинского обеспечения, санитарии, питания в традиционном периоде являются факторами, влияющими на риск злокачественного заболевания радиационной этиологии.
В результате анализа рака молочной железы радиогенного происхождения при малых дозах радиации установлено, что интервал времени между облучением человека и появлением клиники заболевания может существенно изменяться гормональным статусом и другими зависящими от возраста организма факторами, а не дозой воздействия. Радиационно вызванный рак молочной железы не выявляется, пока организм не достигнет возраста, при котором начинает появляться спонтанный рак молочной железы. Повышение дозы воздействия не ускоряет развитие рака молочной железы.
Интересно и другое. Аденомы легких и некоторые другие опухоли легких возникают спонтанно сравнительно часто. Однако при действии радиации их частота обычно уменьшается. Оптимум радиационных доз для индукции ряда опухолей близок к тем дозам, которые начинают вызывать деструктивные процессы. На примере рака молочной железы человека это показано особо четко.
По статистическим данным, среди всех гемобластозов (злокачественные заболевания крови) лейкозы и эритремии составляли 61—65%, а лимфомы — 35—37%. Из них эритремии (краснокровие) возникали крайне редко (всего 4%), или примерно в 6 раз реже, чем острые и хронические лимфолейкозы (белокровие). Характерно значительное преобладание лейкозов с выраженной картиной изменений одного из ростков кроветворения. Лейкозы с выраженными изменениями двух или более ростков встречаются реже — менее 2% от общего числа гемобластозов. По другим данным, эритремия обнаруживается в 10—20 раз реже острого лейкоза.
Удивляет полиэтиологичность лейкозов. В числе возможных причин их возникновения называют радиационный фактор, химические канцерогены, вирусы, дисгормональные расстройства, злоупотребление лекарствами, нейрогенные дисфункции, стресс, хронические инфекционные процессы, хронические раздражения и др.
Сопоставление клинических и экспериментальных данных о возможных классах канцерогенов показало их огромное разнообразие. Перечислим некоторые из них:
1) химические стимулы — органические соединения (нитрозоамины, бензпирены и др.), природные соединения (афлатоксины и др.), гормоны, нуклеиновые кислоты, неорганические соединения (асбест, соединения свинца, бериллия и др.);
2) физические стимулы — ионизирующие излучения, механическое раздражение (хронические раны и ожоги), полимерные включения;
3) внешние биологические стимулы — некоторые паразиты и бактерии, опухолевые вирусы (ДНК — и РНК-вирусы).
Описаны также лейкозы после применения иммунодепрессантов, цитостатиков, некоторых антибиотиков, пирамидона. Известны лейкозы на почве бензольной интоксикации. Кроме того, имеется определенная предрасположенность наследственного характера к злокачественным заболеваниям.
Имеются данные о том, что соотношение частот заболеваемости хроническим лимфолейкозом у взрослых европейцев (около 30% всех лейкозов) и у китайцев и японцев (1,5%) не изменяется, несмотря на иммиграцию населения, что указывает на большую роль наследственных конституционных факторов. Имеется связь между неспецифической устойчивостью детей и предрасположенностью их к заболеванию острым лейкозом.
Среди различных наследственных заболеваний человека и осложнений их определенными видами злокачественных заболеваний лейкоз, включая злокачественную лимфому, наблюдается при ряде наследственных заболеваний. Примерно 9% из 2000 наследственных заболеваний человека связано со злокачественными новообразованиями. Однако из общего количества злокачественных заболеваний лишь 5—10% случаев имеют наследственную природу. Остальные случаи связаны с влиянием множества эндогенных и экзогенных факторов. Подверженность к злокачественному заболеванию определена как комбинация генетической чувствительности и воздействия факторов окружающей среды.
Среди внешних для организма факторов рассматриваются и такие, как характер питания и стрессовая обстановка. В специальных обзорах обсуждаются различные вопросы влияния пищи и расстройств питания, включая те, которые связаны с алкоголизмом и курением, на возникновение различных форм рака. Пища как один из факторов внешней среды может влиять на частоту рака, изменяя в организме состояние отдельных биохимических систем и содержание гормонов. 80—90% случаев заболеваний раком в США связано с воздействием на человека многообразных факторов внешней среды. Среди них на долю факторов питания приходится до 60.% У женщин и до 40% у мужчин. Имеются обобщающие работы о роли стресса в развитии малигнизации.
Проведен анализ большого числа работ по оценке отклонений в состоянии центральной нервной системы или ее особенностей у онкологических больных, включая лейкозных. Изучались также психофизические и психосоциальные особенности больных и делались попытки понять возможный механизм связи стресса и заболевания. Стресс независимо от причины, его вызвавшей, может существенно влиять на развитие различных заболеваний, включая неопластические, хотя механизм такого влияния еще не ясен. Предполагается, что серию биохимических изменений в организме, опосредованных через нейроэндокринпую систему. Имеются данные, что направленным воздействием на центральную нервную систему можно вызвать определенные изменения в иммунологической реактивности и тем самым влиять на условия возникновения и развития опухолей.
Р.Е. Кавецкий указывал, что в создании пред опухолевой предрасположенности могут большую роль играть иммунодепрессивные состояния, вызванные большой группой факторов, среди них наследственное, возрастное и постинфекционное снижение реактивности.
Существование механизмов эндокринного канцерогенеза не вызывает сомнения. Естественное или искусственное значительное и длительное усиление действия гормонов-стимуляторов пролиферативной активности на ткани мишени приводит к малигнизации клеток этой ткани. Так, избыточное и длительное выделение гипофизом тиреотропного гормона может вызывать злокачественные опухоли щитовидной железы.
Нарушения в психофизиологических функциях центральной нервной системы, вызванные стрессом, через нейроэпдокринные регуляции ингибируют или извращают функции иммунной системы. Вследствие этого ослабляется иммунологическая защита организма, что способствует возникновению инфекционных и злокачественных заболеваний, а также аутоиммунных и аллергических расстройств.
Предполагается, что в механизмах таких взаимосвязей большую роль играют реакции макрофагов на гормональный дисбаланс.
Прямыми экспериментальными данными показано, что у животных с пониженной или резко повышенной реактивностью гипофизарно-надпочечниковой системы значительно ускоряется развитие опухолей молочных желез при введении химических канцерогенов. У крыс, резистентных к введению канцерогена, реактивность коры надпочечников и ее андрогенная и глюкокортикоидная функции в предопухолевом периоде остаются без существенных отклонений. У животных с относительно высокими показателями андрогенов и глюкокортикоидов в организме и нормальной реактивностью коры надпочечников опухоли или совсем не возникают на введение химического канцерогена, либо возникают в более поздние сроки и являются доброкачественными (фибромы, фиброаденомы).
На частоту возникновения злокачественных заболеваний влияют и конституциональные особенности организма. Еще Галену было известно, что женщины маланхолики заболевают раком чаще, чем сангвиники.
Иммунологии канцерогенеза посвящено много работ, так же как и рассмотрению процесса канцерогенеза как проблемы биологии развития. Следует, однако, иметь в виду, что система иммунологической защиты на самом деле начинает активно действовать лишь в том случае, когда опухолевые клетки уже имеются в организме, т. е. после того, как уже произошла мэлигнизацня какой-то группы клеток. Поэтому система иммунитета очень важна для' ограничения размножения клеток, для предупреждения их прогрессии, она играет сама ведущей роли в истинном индуцировании малигнизации клеток.
При врожденных дефектах иммунной системы частот злокачественных заболеваний возрастает в сотни раз.
Следует обратить внимание на тот факт, что в популяции с повышенным риском канцэрогенеза или лейкозогенеза в реальных условиях заболевает лишь незначительная ее часть. Организм абсолютного большинства людей, находящихся в таких же условиях канцерогенного и лейкозогенного соприкосновения, справляется с неблагоприятным фактором и остается здоровым. В эксперименте у нормальных животных рост прививной опухоли возникает только в том случае, если было введено в организм более 1000 живых опухолевых клеток, хотя каждая из них способна дать начало опухолевому процессу.
Из изложенного следует важность исследования состояния организма, определяющего возможность или невозможность возникновения лейкоза в условиях соприкосновения организма с лейкозогенными условиями. Следует иметь в виду, что основная масса опухолей человека связана с принципиально устранимыми факторами поведения и образа его жизни.
Большое внимание по-прежнему уделяется вирусной этиологии лейкоза и рака. На этом направлении исследований достигнуты крупные успехи в экспериментах, особенно на мышах и курах. Вместе с тем пока не удалось преодолеть все сложности в изучении возможной вирусной природы опухолей и лейкоза человека. Имеющиеся у приверженцев этого направления исследований данные не могут объяснить весь комплекс эпидемиологических, клинических, патофизиологических, цитологических и биохимических данных о лейкозной болезни человека. Необходимо учитывать невозможность перевивки лейкозов у человека при случайном переливании крови от больных к здоровым, не передается лейкоз от больной матери к плоду и, наоборот, матери от ребенка с врожденным острым лейкозом. Все это говорит против вирусной этиологии лейкоза человека.
В связи с изложенным лойкозогенные вирусы представляются не столько возможными этиологическими, сколько патогенетическими агентами среди других таких же факторов, способных вызвать развитие лейкоза.
Однако исследования с вирусами позволили открыть новую страницу в изучении возможных молекулярных механизмов канцерогенеза. Большие надежды возлагаются на так называемые вирусные онкогены, играющие, по мнению Ф.Л. Киселева и других исследователей, ключевую роль в процессах трансформации нормальных клеток в опухолевые. Но здесь встретились непреодолимые трудности: открыто слишком много вирусных онкогенов — более 20, такие же онкогены выявлены и в нормальных клетках, причем белки онкогенов ретро вирусов и клеток не отличаются, по существу, ни по аминокислотной последовательности, ни по биохимическим, ни по иммунологическим свойствам, часть из них относится к регуляторам роста нормальной клетки и участвует в нормальных процессах пролиферации и дифференцировки. Предполагается, что в связи с нестабильностью генома под влиянием разных причин может осуществляться усиленная экспрессия (активация) онкогенов — тех генетических структур, которые способны трансформировать нормальные клетки в злокачественные в определенных условиях. Детальные исследования молекулярной структуры онкогенов ретро вирусов и клеточных онкогенов показали их идентичность, так же как и идентичность их белков. Более того, они обнаружены и в геноме нормальных клеток, где их функция в основном связана с регуляцией роста клеток и процессов пролиферации и дифференцировки. К тому же для ряда онкогенов четко показана и не специфичность их в вызывании определенных форм рака. Так, вирус острого лейкоза птиц вызывает наряду с лейкозом и опухоли совсем другого типа в печени и почках.
В связи с изложенным возникает сомнение в том, являются ли онкогены первичным механизмом малигнизации клеток, или активация их является вторичной, производной от клеточных изменений и возникшей нестабильности генома, о которых речь будет позднее.
Говоря об экспериментальном изучении возможных механизмов образования злокачественных заболеваний, следует иметь в виду следующие обстоятельства.
В настоящее время довольно успешно исследуются вопросы злокачественной трансформации клеток в культуре. Однако необходимо отметить, что существование популяции клеток в организме и в культуре принципиально отличается. В последнем случае клетки находятся вне влияния тканевого и организменного окружения. Ю.М. Васильев и, И.М. Гельфанд [1981] пишут, что «после перенесения фибробластов и эпителиальных клеток в культуру свойства этих клеток могут претерпевать серию генетически стойких изменений как спонтанных, так и индуцированных. Эта эволюция свойств в культуре обладает рядом черт сходства с неопластической эволюцией клеток в организме» (с. 40).
Следовательно, сам факт переноса клеток в культуру заставляет их приобретать определенные первоначальные черты, приближающие их к злокачественной трансформации (изменение формы клеток и их поверхности, появление способности размножаться в условиях, в которых ранее они не размножались, изменение чувствительности к росторегулирующим веществам и др.). Клетки, размножающиеся в культуре,— это клетки, уже вступившие на путь, ведущий к трансформации. Надо быть очень осторожным при попытках использовать данные, полученные в культуре, для исследования первичных механизмов злокачественной трансформации клеток в организме.
То же самое и с оценкой результатов экспериментов на животных. Абсолютное большинство опытов проводится или на специально подготовленных, или генетически дефектных животных, или при очень далеких условиях перевивки лейкозогенного фактора от условий, в которых находится заболевший человек.
Поэтому в настоящее время ряд исследователей основное внимание уделяют попыткам понять возможные механизмы канцерогенеза для реальных условий окружения человека. При этом подчеркивается необходимость изучения прежде всего пред раковых состояний. Наиболее подробно в клиническом и экспериментально-морфологическом аспекте Л. М. Шабадом изучено предраковое состояние. Он различает следующие друг за другом четыре стадии опухолевого процесса: 1) диффузная или неравномерная гиперплазия (т. е. разрастание ткани за счет клеточного размножения); 2) очаговые пролифераты (т. е. узлы таких разрастаний ткани); 3) доброкачественная опухоль (не имеющая тенденции к безудержному росту); 4) злокачественная опухоль. Его взгляд на роль предварительной гиперплазии с очаговой (узелковой) пролиферацией подтвержден последующей работами.
Следовательно, вопросы нарушения роста и размножения клеток, нарушения дифференцировки клеток — приобретения ими специфических функций, необходимых организму, должны исследоваться в первую очередь. Особое внимание при этом надо уделять тем изменениям, которые являются характерными для реального злокачественного заболевания человека, в частности лейкоза.
Некоторые клинические особенности лейкоза
Лейкоз относится к гемобластозам, т. е. к группе опухолей, возникающих из кроветворных клеток. Лейкоз — это гемобластоз, при котором костный мозг повсеместно заселен опухолевыми клетками. Термин лейкемия менее целесообразен но двум причинам: 1) к лейкозам относятся опухоли, состоящие не только из лейкоцитов, но и из других клеток (эритрокариоцитов или мегакариоцнтов), и 2) появление в крови избытка лейкоцитов не обязательно в начале болезни. Кроме лейкозов, в группу гемо-бластозов входят гематосаркомы — солидные опухоли, возникшие вне костного мозга из кроветворных бластных клеток. Лимфомы могут состоять из зрелых лимфоцитов или образуются разрастаниями, идентичными лимфатическому узлу. Клетки гематосарком и лнмфом могут распространяться по системе кроветворения и поражать костный мозг. Тогда они не отличаются от острого лейкоза или хронического лимфолейкоза.
Практика показала, что диагноз острого лейкоза может быть уверенно установлен только по обнаружению в периферической крови или в костном мозге бластных опухолевых клеток. Сколько-нибудь характерного начала со стороны клиники или жалоб больного, свойственных острым лейкозам, найти не удается.
Клинические признаки лейкоза описаны достаточно хорошо только для той стадии развития заболевания, когда больной обращается к врачу, как правило, по поводу не специфических для лейкозов жалоб. В большинстве случаев к этому времени у больного уже определились специфические изменения в крови и клинические симптомы, позволяющие поставить диагноз острого или хронического лейкоза определенной формы в соответствии с принятой классификацией их, основанной на выделении ведущего ростка кроветворения и стадии созревания клеток в нем, затронутых болезнью.
Большое значение в современной диагностике лейкозов имеют и определенные изменения хромосомного аппарата.
Отдельные особенности течения развитого лейкоза
В пестрой и многообразной картине каждой из форм лейкозов все же можно выделить некоторые особенности, представляющие интерес для последующего обсуждения.
Весьма часто можно наблюдать неодинаковую выраженность изменений содержания зрелых форм различных ростков в периферической кроки. Преобладание числа зрелых форм одного ростка может сопровождаться уменьшением в крови зрелых форм других ростков кроветворения. Так, при остром миелолейкозе нередко могут наблюдаться явления анемии, тромбоцитопенни, а при хроническом лнмфоленкозе — анемии, тромбоцптопешш, граиулоцитопеиии.
Среди хронических миелоидных лейкемий иногда различают эозинофильную, базофильную и иейтрофиль-ную лейкемии. При ряде форм лейкозов (острый и хронический миелобластный и хронический лимфолейкоз) может отмечаться увеличение селезенки и реже печени. В начале заболевания хроническим миелолейкозом селезенка увеличена у 85% больных.
Продолжительность жизни эритроцитов и лейкоцитов, особенно при хронических формах, сокращена. При этом обнаружена прямая корреляция между увеличением размера селезенки (гиперспленизм) и сокращением продолжительности жизни эритроцитов. Берлин и соавторы, обобщая сведения о продолжительности жизни эритроцитов при различных заболеваниях крови, пришли к выводу, что 73 больных хронической миелоидной лейкемией имеют укороченную продолжительность жизни эритроцитов. При этом эритроциты, перелитые от здорового человека в кровь таких больных, также имели укороченную продолжительность жизни. Авторы делают вывод, что укорочение продолжительности жизни эритроцитов у этих больных не связано с качеством эритроцитов, а определяется внеклеточными для них факторами.
Сокращение продолжительности жизни эритроцитов (а также лейкоцитов) нередко связано с развитием аутоиммунного гемолиза, например при хроническом лимфолейкозе, и может проходить и без увеличения селезенки даже без классических признаков усилепия гемолиза.
При лейкозах, сопровождаемых явлениями гиперсплепизма, удаление селезенки оказывает хотя и временное, но значительное клиническое улучшение. При этом продолжительность жизни эритроцитов существенно возрастает и приближается к нормальной. На основании эффекта удаления селезенки И. А. Кассирский и Г. А. Алексеев делают заключение о важной роли селезенки в ускоренном разрушении эритроцитов у больных миелолейкозом, у которых в период обострения в 80% случаев продолжительность жизни эритроцитов укорочена.
Следовательно, одной из важных особенностей течения лейкоза является вовлечение в патологический процесс эритроидного ростка костного мозга, изменения в котором имеют большое прогностическое значение.
В классических работах, вышедших до широкого применения кортикостероидных препаратов и цитостатических иммунодепрессантов, более определенно, чем в гематологических руководствах последнего времени, оценивалось значение изменений красной крови в мило — и лимфо лейкозах для прогноза заболеваний, а также сама возможность выздоровления.
Прежде считалось, что для ранних этапов острого лейкоза типично развитие анемии. Однако позднее сложилось убеждение, что симптом анемии, во всяком случае, для острого лейкоза, может долго не выявляться. Важнейшей задачей лечения лейкозов И. А. Кассирский и Г. А, Алексеев [1970] считают сохранение и восстановление красного кроветворения, и борьбу с анемией (в том числе при миелоидном и лимфоидном лейкозах), а критерием положительного лечебного эффекта — улучшение в первую очередь состава красной крови.
В старых руководствах лейкоз однозначно считался неизлечимым заболеванием, летальный исход которого можно было лишь отдалить. Случаи самопроизвольного или под влиянием терапии излечения считались казуистическими, и правильность диагноза ставилась под сомнение.
С введением в практику лечения лейкозов кортикостероидных и специальных цитостатических препаратов взгляд на возможность излечения от лейкоза принципиально изменился. Появление полных гематологических ремиссий, исчисляемых многими месяцами и годами, с восстановлением физиологической регенерации крови позволило поставить вопрос о принципиальной и практической обратимости острого лейкоза. В отношении хронических лейкозов это стало понятным намного раньше.
В связи с изложенным изменилось и отношение к случаям самопроизвольного излечения от лейкоза или возникновения спонтанных и длительных ремиссий. Эти сведения стали серьезно изучаться. И.А. Кассирский и Г.А. Алексеев (1970] собрали имевшиеся в литературе сведения о самопроизвольных ремиссиях, которые возникли у 104 больных острым лейкозом, в том числе у 67 из них причиной ремиссии были нагноения, у 35 — инфекция, у 2 — пневмония. Имеются отдельные случаи очень длительных ремиссий острого лейкоза, вызванные инфекцией (до 10 лет) и нагноениями (до 12 лет).
Описаны два случая ремиссии острого лейкоза до 1—3 лет, вызванные беременностью. Однако имеются и другие, более многочисленные примеры отягощающего действия инфекции, которая является главной непосредственной причиной смертельных исходов при лейкозах. У обезьян как видовая особенность течения гемобластозов отмечено сравнительно частое возникновение спонтанных ремиссий, иногда до 4 лет и более, т. е. практически полное самовыздоровление.
В литературе описано около 600 случаев ремиссий и самоизлечения от рака под влиянием лихорадки, инфекции, вакцинации, гормональных изменений, хирургических операций и сделан вывод, что это связано с изменением взаимоотношений между организмом и опухолевым процессом. И.А. Кассирский и Г.А. Алексеев (19701 приводят сведения и о том, что имелись случаи, когда больных хроническим лимфолейкозом выписывали из стационара как безнадежных, однако у них в дальнейшем исчезали клинические и гематологические проявления заболевания.
Влияние указанных факторов на возникновение спонтанных ремиссий и само выздоровления при лейкозах, по-видимому, обусловлено воздействием их на собственные физиологические защитные силы организма с активизацией их, и в первую очередь активизацией механизмов иммунологической защиты. Имеется прямая связь между частотой возникновения неоплазм и иммунологическим статусом организма. Для нас существенно, что концепция иммунологического надзора привлекает основное внимание не к самому опухолевому процессу, а к состоянию организма, его защитных сил.
Таким образом, в отдельных случаях лейкоз не является заболеванием с неотвратимо неблагоприятным исходом. В тяжести течения и в исходе заболевания значительную роль играют собственные физиологические защитные силы организма. Сохранение избыточной или извращенной функции их при некоторых формах лейкоза предполагает возможность подхода к лейкозам как к своеобразным болезням компенсации.
Клинические проявления предлейкоза
Особое внимание в настоящее время уделяется начальным проявлениям лейкоза и предлейкозным состояниям, которые, как правило, остаются вне наблюдения специалистов, но могут быть определены в ряде случаев ретроспективно. В последнее десятилетие укоренился термин «предлейкозный синдром» для характеристики состояния организма перед развитием, безусловно специфических для лейкоза клинических проявлений. Однако оказалось очень трудным отделить начальные проявления лейкоза от тех проявлений, которые можно отнести к предвестникам возможного, но не обязательного развития в последующем лейкоза.
К проявлениям пред лейкозного синдрома относят, прежде всего явления анемии, которая может быть разного типа. Эта анемия сопровождается часто сокращением продолжительности жизни эритроцитов и увеличением селезенки. Иногда отмечаются изменения размеров и формы эритроцитов. Часто наблюдается гиперпластичный костный мозг с преобладанием красного ростка. В периферической крови, кроме уменьшения числа эритроцитов, нередко обнаруживают уменьшение числа лейкоцитов или тромбоцитов и тогда говорят о явлениях цитопении. В отдельных случаях отмечается сохранение числа эритроцитов и гемоглобина на уровне верхних показателей нормы при нестабильности числа лейкоцитов или уменьшении их и некотором увеличении числа ретикулоцитов. Может развиваться типичная миелопролиферативная реакция костного мозга, неотличимая от реакции, возникающей по другим причинам.
Появление дефектов созревания предшественников эритроцитов, гранулоцитов или моноцитов или дефектов в мегакариоцитах при нормо- или гиперпластичном костном мозге обычно относят к начальным признакам лейкоза, хотя и они не являются абсолютно надежным свидетельством начавшегося развития лейкоза.
М. Сарни и Дж. Линман в 1973 г. обобщили литературные сведения о 143 случаях достаточно надежного диагноза «предлейкозный синдром». Этот диагноз ставился редко. Так, в одной группе из 322 больных острым лейкозом достаточных сведений для ретроспективной постановки диагноза «предлейкозный синдром» было только в 21 случае, когда острый лейкоз развился спустя 3— 39 мес. В другой группе из 580 больных ни у одного больного не оказались достаточными ретроспективные данные для рассмотрения вопроса о наличии или отсутствии у них симптомов предлейкозного синдрома. У тех 143 больных, у которых можно было поставить диагноз «предлейкозный синдром», наблюдались разнообразные, но совершенно неспецифические проявления; среди них в 10—15% случаев — увеличение селезенки и печени, инфекция. Анемия изолированно или в сочетании с нейтропенией и тромбоцнтопениеп в различных комбинациях была в большинстве случаев. Отмечались нередко изменения размеров и формы эритроцитов. Однако в большинстве случаев наблюдали нормохромные эритроциты. В небольшом числе в крови появлялись ядерные эритроциты. Число ретикулоцитов — в норме или слегка увеличено. В большинстве случаев костный мозг был гиперплазирован (увеличен в размерах) в основном за счет красного ростка с возникновением в ряде случаев мегалобластических изменений — появлением наиболее ранней морфологически различаемой клетки. Гранулоцитарный отдел костного мозга обычно характеризовался смещением влево гранулоцитарной формулы, отмечали умеренное увеличение ранних предшественников и запрет па созревание клеток. Выживаемость меченных эритроцитов или нормальна, или сокращена. Фетальный гемоглобин может быть увеличен. Уровень в плазме крови витамина Bi2 и солей фолиевой кислоты не уменьшен, и терапия этими препаратами неэффективна. Продолжительность периода от постановки диагноза «предлейкозный синдром» до развития лейкоза — чаще всего от 6 мес. до 5 лет, но может быть н значительно больше, например до 20 лет.
Авторы представили и результаты собственных клинических наблюдений. Из 132 больных с обостренной миеломоноцитарной лейкемией только в 34 случаях было достаточно данных для детального анализа состояния перед развитием лейкоза. Среди них увеличение селезенки или печени отмечено у 10 человек, анемия в сочетании с лейкопенией и тромбоцитопенией или без них — у абсолютного большинства (29 больных), нормальный или несколько увеличенный процент гемоглобина — у 25 человек, изменения размеров или формы эритроцитов — у всех, появление ядерных эритроцитов в крови — у 23, гиперплазия костного мозга — у 26 (гипоплазия лишь у одного), эритроцитарная гиперплазия — у 17 больных (эритроцитарная гипоплазия — лишь у трех). Среди причин обращения к врачу в пяти случаях — инфекционные процессы. В эритроцитарном отделе костного мозга нарушения созревания предшественников выявлены у 30 человек, столько же — в других отделах.
В заключение авторы указывают, что приведенные материалы по предлейкозным симптомам многие относят к заболеваниям, не несущим плохой прогноз злокачественной болезни, например к рефрактерной анемии, сидеро-бластической анемии, апластической анемии, пиридоксин-связанной анемии, пароксизм альной гемоглобинурии, гиперспленизму.
Имеются обобщенные данные о 131 случае предлейкоза. В 114 случаях (87%) встречалась анемия в чистом виде (в 30 случаях) или в сочетании с лейкопенией, тромбопенией или нанцитопенией. Лейкопению наблюдали лишь в восьми случаях (6%), и еще реже только тромбопению — в пяти случаях (менее 4%). Следовательно, наиболее частый гематологический синдром в предлейкозный период — анемия в различных ее формах.
Имеются данные, что у больных арегенеративной или рефрактерной анемией с гиперплазией костного мозга и патологическим накоплением промежуточных сидеробластов более чем в 50% случаев болезнь заканчивается острым лейкозом.
Обобщая данные наблюдений других авторов о предлейкозном состоянии детей, у которых в дальнейшем развилась острая лимфобластная лейкемия, можно считать, что во всех случаях у них регистрировалась анемия гипопластического типа. В этот период никаких оснований для диагноза лейкоза не было. Анемия проходила сама или под влиянием преднизолона.
Таким образом, ведущие события в период, предшествующий появлению симптомов, достаточных для постановки диагноза «лейкоз», связаны с нарушениями в системе красной крови.
Симптомы описанного выше предлейкозного синдрома относятся к проявлениям патологического характера. В то же время для наиболее изученной по этиологии форме лейкоза — радиационного лейкоза известен длительный период полного клинического благополучия от воздействующего лейкозогенного агента (радиации) до появления симптомов предлейкозного синдрома. Этот период может исчисляться многими годами и даже десятилетиями. Так у лиц, благополучно перенесших острый период после' воздействия радиации в Хиросиме, через 2 года в периферической крови никаких отклонений от контрольной группы не обнаружено. В дальнейшем среди этих людей отмечены случаи заболевания лейкозом радиационной этиологии, т. е. было длительное клиническое и гематологическое благополучие перед появлением начальных признаков радиационного лейкоза.
Особенности эритремии и возможность общей гемобластозной болезни
Следует также остановиться на более доброкачественной форме гемобластоза — эритремии, которая встречается очень редко. Болезнь характеризуется увеличенным содержанием числа эритроцитов и их массы, циркулирующей в крови, увеличением селезенки, гиперпластичным костным мозгом. Отмечают, что переход зритремий в острый лейкоз происходит редко. Под влиянием радиотерапии (рентгеновское облучение или радиоактивный фосфор) вероятность перехода в острый лейкоз возрастает примерно в 10 раз. Чаще всего происходит переход в эритромиелоз с явлениями панмиелоза и реже — в хронический мило — или лимфо лейкоз.
Обращает на себя внимание наличие переходных форм заболеваний между «чистым» миелоидным или лимфоидпым лейкозом (белокровием) и типичной эритремией (краснокровием). Клиницисты давно обратили па это внимание.
Г.А. Алексеевым в 1950 г. описаны клинические случаи постепенного развития болезни от типичной эритремии (краснокровия) к хроническому мнелолейкозу (белокровию). Он рассматривал их как последовательные стадии одного болезненного процесса и обращал внимание на случаи эритролейкемий, сочетающих в себе одновременно признаки эритремии и хронического мило лейкоза. Эритролейкемию можно рассматривать как переходную стадию в развитии острой миелобластной и миеломоноци-тарной лейкемий.
Обобщив собранный материал с учетом приведенных экспериментальных материалов, далее мы излагаем сложившиеся представления об основных периодах развития такой общей гемобластозной болезни в типичный белокровный лейкоз в виде упрощенной схемы (табл. 1).
Таблица 1. Основные периоды клинического состояния при общей гекобластозпой болезни после воздействии лейкозогенного фактора (радиации и ДР.)
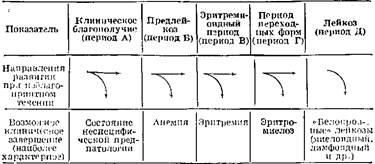
Первый период — период клинического и гематологического благополучия (период А). После воздействия лейкозогеиного агента (например, радиации) отмечается длительный период (измеряемый годами и иногда десятилетиями) полного благополучия. Отсутствуют клинические и гематологические расстройства при использовании традиционных клинико-лабораторных методов обследования больных. Нет никаких оснований предполагать возможность каких-либо отдаленных последствий у абсолютного большинства лиц, подвергавшихся воздействию лейкозогенного фактора. Далее возможны три исхода:
а) сохранение полного клинического и гематологического благополучия без каких-либо отдаленных последствий;
б) развитие специфических по отношению к лейкозу потенциально патологическнх состояний, выявляемых в первый период времени лишь при функциональных нагрузках или при использовании специально разработанных методик исследований. У большинства лиц наблюдается обратное развитие в сторону полного клинического и гематологического благополучия без каких-либо последствии. При неблагоприятном течении этих состояний могут начать проявляться некоторые не ярко выраженные отклонения в гематологических показателях, однако с благоприятным дальнейшим исходом; в) развитие такого же неспецифического по отношению к лейкозу потенциально патологического состояния, переходящего в следующий период предлейкозного состояния. Это характерно лишь для небольшой части лиц, находившихся в лейкозогенной обстановке.
Второй период — период предлейкоза (период Б). В этот период медленно нарастают изменения со стороны показателей периферической крови и костного мозга. Ведущее значение имеют изменения со стороны красной крови. Эти изменения вначале носят скрытый характер, выявляемый лишь функциональными нагрузками или специальными методиками исследований. Затем они приобретают клинически заметные формы — неустойчивость содержания лейкоцитов, гранулоцптов и тромбоцитов в крови, уменьшение их числа по одному или нескольким росткам, реже панцитопеиия. В костном мозге соотношение бластных форм красного и белого ряда смещается чаще в сторону краспого ряда. Все эти изменения не дают еще четкой картины для уверенной постановки диагноза какого-либо заболевания.
При благоприятном течении изменений, что наблюдается у большинства лиц, каких-либо последствий не ожидается. В организме восстанавливается полное клиническое и гематологическое благополучие.
Однако при неблагоприятном течении возникших изменений эти состояния могут постепенно перерастать в клинически выраженную форму, достаточную для постановки диагноза анемии. В этот период ускоренно разрушаются эритроциты в селезенке и печени. В костном мозге чаще развивается компенсаторная гиперплазия с преобладанием пролиферативных процессов в красном ростке. К анемии может присоединяться снижение числа клеток других ростков крови. Но ведущими и наиболее стойкими симптомами являются изменения со стороны красной крови. Анемия практически трудно курабельна, но может проходить и без лечения. Однако она может перерастать и в следующий период общей гемобластозной болезни.
Иногда рассматриваемый период не имеет четко выраженных изменений и остается вне внимания исследователя, когда он впервые обращает внимание лишь на последующие периоды.
Третий период — период эрнтремиоидного состояния (период В). В этот период происходит внешне благоприятное изменение со стороны красной крови. Явления анемии сглаживаются. Число эритроцитов в крови восстанавливается до нормы или слегка превышает ее. Аналогичное положение с содержанием гемоглобина. Такое состояние можно рассматривать как следствие успешного развития реакций компенсации в ответ на недостаток эритроцитов и ускоренное разрушение их. Однако компенсация крайне неустойчива и может переходить в сверх компенсацию, когда появляется избыток эритроцитов в периферической крови (это может завершаться эритремией как самостоятельным заболеванием), или в срыв компенсации, когда появляется панцитопения. Костный мозг может быть разным: от гиперплазированного по красному ростку до тотальной гиперплазии (что бывает реже) и до гипопластического состояния (что встречается очень редко).
Этот период может остаться для клинициста и незамеченным, если не проводятся исследования костного мозга, а изменения в крови не достигли серьезных отклонений. При отсутствии исхода в эритремию неустойчивое состояние кроветворения не может оставаться неизменным длительные сроки. При тотальной гиперплазии по красному и белому росткам может начаться следующий период развития общей гемобластозной болезни.
Четвертый период — период переходных клинических форм (период Г). Этот период также неустойчивый. Он характеризуется промежуточным состоянием кроветворения, когда нет выраженного преобладания клеток одного из ростков, когда костный мозг одновременно гиперплазирован по красному и белому росткам, но может отмечаться и гипоплазия по всем росткам. Предпочтительное производство клеток красной крови начинает сменяться, но еще сменилось предпочтительным производством клеток другого ряда.
В редких случаях такое промежуточное состояние проявляется клиническим выходом в форме такого самостоятельного заболевания, как эритромиелоз. Клетки крови продолжают ускоренно разрушаться в крови.
Однако чаще именно на этой стадии завершается переключение примата производства с красного ростка па миелоидный росток (гранулоцитарный, моноцитарный или на производство их общего предшественника) или па лимфоцитарпый росток. Соответственно начинает изменяться и периферическая кровь. Наблюдается ограничение пролифератпвной активности красного ростка костного мозга, последующее подавление или истощение его с гиперплазией других ростков, уменьшение числа эритроцитов до нормы и ниже ее, увеличение числа клеток белой крови до нормы.
Пятый период — период типичного лейкоза (период Д). Это завершающий период развития общей геыоблагтозной болезни в типичные «белокровиные» лейкозы. Значительное увеличение числа клеток белой крови в начальный период не обязательно, в дальнейшем — характерно.
Развитию лейкоза не обязательно предшествует гиперплазия костного мозга. Он может быть и истощенным вследствие предшествующего длительного периода гиперплазии. Чаще всего тот росток, из которого развивается в дальнейшем «белокровный» лейкоз, находится в угнетенном состоянии. Это первое правило лейкозной опухолевой прогрессии по А. И. Воробьеву. Содержание клеток других ростков в крови уменьшено в различной степени.
Эта идеализированная схема необходима, чтобы на ее основе попытаться понять закономерную последовательность появления разнообразных симптомов. Схема поясняет периоды развития общей болезни, закономерность промежуточных выходов в клинические формы, как будто бы не имеющие прямой патогенетической связи с типичным лейкозом. В то же время схема поясняет возможность скрытого с точки зрения заметных внешних клинических симптомов прохождения заболевания непосредственно до «белокровных» лейкозов.
Главное, по нашему мнению, заключается в том, что схема предусматривает длительный период неспецифических пред патологических состояний, который, как будет показано далее, позволит, попять многие вопросы патогенеза лейкоза и их связь с нормальными возрастными изменениями.
В реальной клинической картине правильность этой упрощенной схемы проверить трудно из — за огромного разнообразия возможных форм заболеваний и их проявлений, обусловленных, во-первых, тесной взаимосвязью всех ростков кроветворения, объединяющей происходящие в них процессы в одну общую системную гемобла-стозную болезнь, и во вторых, клоповым характером кроветворепия и воспроизводством возникших нарушений в последующих генерациях клеток, разъединяющих процессы клеток одного ростка от клеток других ростков и создающих в ряде случаев конкурентные отношения между ними за преимущественную продукцию своих клеток. Конкретная форма заболевания определяется не только местом первоначальной бластной трансформации в ряду конкретных стадий созревания клеток данного ростка или их предшественников, но и возможностями развития замешающих и компенсаторно-восстановительных реакций организма.
Эти реакции компенсации могут приобретать также патологический характер. В связи с этим следует обратить внимание на своеобразную группу хронических лимфолейкозов — парапротеинемическнх гемобластозов, отличительной чертой которых является способность вырабатывать в большом количестве иммуноглобулины — один из важнейших факторов гуморального иммунитета организма.
Кроме того, имеются большие группы незлокачественных заболеваний крови (аграпулоцптозы и анемии), в патогенезе многих форм которых избыточные или извращенные реакции гуморального или клеточного иммунитета играют важную роль. В этиологии этих заболеваний инфекционному фактору, стимулирующему иммунные реакции, или химико-токсическому фактору, извращающему их, отводится важное место. Это подчеркивает необходимость исследования в механизмах возникновения предлейкозных состояний возможных избыточных и извращенных реакции компенсации.
Экспериментальные лейкозы собак
Частота спонтанных лейкозов у собак в отличие от наблюдений на мышах и крысах близка к частоте их развития у человека. Кроме того, в условиях хронического радиационного воздействия в суммарной дозе 40—70 Гр, вызывающей гибель собак через 2—6 лет после начала облучения, риск смерти этих животных от лейкоза весьма близок к такому риску у человека. В то же время естественный риск смерти от лейкоза у мышей в 10— 100 раз выше, чем у человека.
Из этого следует особая ценность исследования механизмов развития лейкоза и предлейкозных состояний на экспериментальной модели собак. Сведения о лейкозах у собак очень ограниченны. Вероятно, это связано и с тем, что постановка массовых и длительных опытов на собаках недоступна для широкого экспериментирования. Тем не менее, некоторые характерные данные о лейкозах у собак оказались очень ценными.
Наиболее подробное описание проявлений лейкоза и, что особенно важно, предшествующих ему проявлений предлейкоза приводит М. С. Лаптева-Попова. Ей удалось воспроизвести экспериментальные лейкозы у собак путем t систематического воздействия малых доз рентгеновских лучен. В начальный период развития лейкоза число лейкоцитов не изменялось, и лишь за 1—2 недели до смертельного исхода содержание лейкоцитов начинало нарастать. Во всех случаях одновременно отмечали гиперхромпуго макроцитарную анемию.
Систематические исследования крови и костного мозга позволили автору отметить определенные изменения, предшествовавшие выраженным проявлениям заболевания. За 4—7 мес. до начала клинического заболевания в периферической крови стали изредка появляться единичные незрелые клетки костного мозга (миелобласты, промиелоцнты). Наряду с уменьшением числа эритроцитов появлялись в периферической крови и эритробласты, иногда в значительном количестве. Число тромбоцитов резко колебалось.
Интересны наблюдения автора и в более ранний период, когда еще отсутствовали в периферической крови какие-либо патологические или незрелые формы клеток. Появление в периферической крови эрптробластов на фоне снижения числа эритроцитов и гемоглобина свидетельствовало о крайнем напряжении эригропоэза.
В случае двухмесячного перерыва в облучении число эритроцитов повысилось с 3,5 до 5 млн./мм3 крови, повышенное количество лейкоцитов возвратилось к норме, резкие колебания в числе тромбоцитов прекратились, исчезли миелобласты, число которых в крови до перерыва в облучении доходило до 2%. Базофилы тоже исчезали. Однако через месяц после возобновления облучения появилась, четкая картина подстрой формы миелоидного лейкоза.
Интересное наблюдение привел Е. Н. Антипенко. У одной собаки из тех, которые еще жили 27,5 мес. после воздействия облучения в дозе 6,5 Гр с последующим симптоматическим лечением в течение месяца, обнаружили лимфосаркому. Эта собака при обследовании до 8 мес. после воздействия радиации ничем не выделялась в своей группе. Через 8 мес. все показатели периферической крови были в норме (число эритроцитов, лейкоцитов, ретикулоцнтов, тромбоцитов, содержание гемоглобина, лейкоцитарная формула). Однако по величине отношения клеток миелоидного ряда к клеткам эритроидпого ряда в костном мозге она значительно выделялась. Это соотношение было равно лишь 0,5, в то время как у всех остальных собак отношение превышало единицу. Повторное исследование костного мозга через 9,5 мес. после облучения снова показало низкую величину этого отношения; оно стало еще меньше — 0,4. Через 1,5 года после этого обследования собака погибла от лимфосаркомы.
Следовательно, в этом опыте было отмечено значительное преобладание эритроидных элементов падмиелоидны мир в костном мозге задолго (за 1,5 года) до развития лимфосаркомы. И в этом случае норма показателей периферической крови сопровождалась существенной гиперплазией красного костного мозга в предлейкозный период. Значительный интерес представляют исследования на чистопородных гончих собаках, систематически облучавшихся гаммарадиацией в малых дозах, У них лейкоз появляется в среднем через 24—35 мес. с начала облучения. Анемия обнаруживалась значительно раньше и сопровождалась глубокой тромбоцитопенией.
Имеются сообщения о результатах других работ на чистопородных гончих собаках, которых систематически облучали. Из восьми облученных собак шесть погибли от лейкемии. В пред лейкемический период у них отмечали анемию, изменение формы эритроцитов, появление ядерных эритроцитов, левый сдвиг гранулоцитов, увеличение числа моноцитов и др. В случае эритролейкемии за три педели до смерти в периферической крови впервые обнаружили выраженный эритробластоз. Пункция костного мозга за три недели до гибели у одной собаки показала дефекты созревания клеток эритроидного ряда с полиплоидией фигур деления, почкующимися ядрами, хромосомными мостами. У другой собаки с посмертным диагнозом «хронический грануло-мегакариоцитарный миелоз» анемия появилась еще за 13 мес. до смерти. У всех собак масса селезенки и печени была увеличена.
Отметим, что лейкоз относится к наиболее изученным формам злокачественных образований, по которым имеются надежные эпидемиологические данные и наиболее массовые случаи заболеваний, особенно радиационной этиологии. Выяснены некоторые особенности клинических проявлений заболевания, как в период развитого лейкоза, так и в предлейкозный период. Обращено внимание на большое значение изменений со стороны красной крови и определенную связь в возникновении лейкоза с состоянием организма и неспецифическими по отношению к лейкозу изменениями в его важнейших системах. Эти изменения являются общими и предшествуют ряду разнообразных клинических форм патологии, включая возрастную, т. е. определяют состояние предпатологии.